El doctor Román Freixa Pamias, cap del servei de cardiologia del Complex Hospitalari Moisès Broggi, va oferir una ponència sobre insuficiència cardíaca. La xerrada va formar part de la segona sessió del Curs de Formació Continuada en Gerontologia Clínica i Cures Pal·liatives 2023.
En primer lloc, volem introduir diferents aspectes claus en el diagnòstic i en el tractament de la insuficiència cardíaca. En concret, en aquests darrers anys, s’han produït diverses novetats importants, tant en el diagnòstic com especialment en el tractament de la insuficiència cardíaca.
Així doncs, la prevalença de la insuficiència cardíaca va augmentant any rere any. D’una banda, això es relaciona amb l’envelliment progressiu de la població i l’increment dels factors de risc cardiovasculars, especialment l’obesitat i la diabetis mellitus. De l’altra, també es deu a un millor tractament de les cardiopaties en fase aguda, com l’angioplàstia primària en pacients amb infart agut de miocardi. Així, ens trobem amb un major nombre de pacients amb malalties cròniques cardiovasculars que amb el temps poden acabar patint una insuficiència cardíaca.
Criteris diagnòstics: com ho fem?
Es tracta d’una síndrome clínica on hi ha símptomes i signes d’insuficiència cardíaca causats perquè hi ha una anomalia cardíaca estructural o funcional. Aquesta síndrome clínica es pot confirmar perquè hi ha una elevació de pèptids natriurètics o signes congestius molt evidents en l’àmbit pulmonar o sistèmic. Les guies europees, que van ser publicades l’any 2021, plantegen un algoritme diagnòstic de la insuficiència cardíaca. Concretament, aquest algoritme diagnòstic es basa en tres punts claus: la història clínica del malalt amb els factors de risc cardiovascular, els signes i els símptomes i l’electrocardiograma anormal, els pèptids natriurètics amb uns punts de tall molt determinats i l’ecocardiograma.
Criteris diagnòstics: història clínica del malalt
En el primer punt, és molt important tenir en compte davant de quin malalt ens trobem. Per aquest motiu, cal fer una bona història clínica i un bon recull dels factors de risc que presenta la persona. Cal preguntar especialment per hipertensió, diabetis, antecedents de cardiopatia isquèmica, consum important d’alcohol, malaltia renal crònica, antecedents de càncer o tractament quimioteràpic. Recollir a la històrica clínica els factors de risc és decisiu per identificar les persones malaltes que tinguin més risc de patir una insuficiència cardíaca. També cal avaluar els símptomes, tot i que a vegades l’avaluació clínica és dificultosa perquè aquests poden ser poc específics o causats per altres patologies.
D’una banda, els símptomes més típics d’un malalt amb insuficiència cardíaca són dispnea, ortopnea, dispnea paroxística nocturna, tolerància reduïda a l’exercici, fatiga i cansament, inflament dels turmells, incapacitat per fer exercici, inflament d’altres parts del cos que no siguin els turmells i bendopnea. D’altra banda, els signes més específics d’un malalt amb insuficiència cardíaca són pressió venosa jugular elevada, ritme de galop amb tercer i quart to, cardiomegàlia i impuls apical desplaçat lateralment, reflux hepatojugular i respiració de Cheyne-Stokes en insuficiència cardíaca avançada. Tot i això, cal recordar que poden produir-se a altres patologies.

Criteris diagnòstics: pèptids natriurètics
El segon punt és un aspecte clau, sobretot davant d’un malalt que presenta dispnea, és a dir, un malalt que s’ofega. En aquest sentit, si fem una determinació del pèptid natriurètic i tenim un valor de NTproBNP per sota de 125 pg/mL, podem concloure que el pacient no té insuficiència cardíaca, amb un alt valor predictiu negatiu. Hi ha diversos punts de tall per definir si es té una insuficiència cardíaca o no en funció de l’edat o de les patologies relacionades.
No obstant això, hi ha diferents patologies que poden elevar els pèptids natriurètics i que podrien generar una certa confusió. Algunes d’elles són l’anèmia, l’ictus, alguna patologia infiltrativa o alguna patologia inflamatòria. Per sort, cada vegada, tenim major accessibilitat i la majoria de centres d’atenció primària poden sol·licitar l’estudi dels pèptids natriurètics de la persona malalta. Aquest ha estat un avanç molt recent, d’aquest any. Així doncs, amb els valors NTproBNP, podem descartar d’insuficiència cardíaca en l’àmbit ambulatori si es troben per sota de 125 pg/mL. També podem destacar una insuficiència cardíaca aguda si els valors NTproBNP estan per sota de 300 pg/mL.
També, en funció de l’edat del malalt, hi ha diversos punts de tall. Així, a mesura que el pacient es va fent gran, demanem que hi hagi un valor més elevat per poder valorar l’existència d’una insuficiència cardíaca. De la mateixa manera, es necessiten indicadors elevats per a malalts amb fibril·lació auricular i per a malalts amb insuficiència renal.
Criteris diagnòstics: ecocardiograma
En el tercer punt, cal fer un ecocardiograma per mesurar la fracció d’ejecció i avaluar alteracions estructurals o funcionals del cor. L’ecocardiograma també pot ajudar a acabar de caracteritzar l’etiologia d’aquesta insuficiència cardíaca, dient-nos si es té una cardiopatia isquèmica, hipertensiva, valvular o miocardiopatia dilatada. Alguns aspectes rellevants que expliquen una insuficiència cardíaca són la velocitat d’insuficiència tricúspide en repòs o el volum indexat de l’aurícula esquerra, entre d’altres.
Criteris diagnòstics: avaluació diagnòstica integral
Des de l’any 2021, hem canviat la classificació. Actualment, tenim tres grups: insuficiència cardíaca amb fracció d’ejecció reduïda (per sota del 40%), insuficiència cardíaca amb fracció d’ejecció lleugerament reduïda (entre el 41% i el 49%) i insuficiència cardíaca amb fracció d’ejecció preservada (per sobre del 50%). A més de classificar en funció de la fracció d’ejecció, es recomana fer un estudi etiològic per intentar entendre per quin motiu té insuficiència cardíaca. Alguns d’aquests motius poden ser malaltia coronària, hipertensió arterial, valvulopatia, arrítmia o miocardiopatia. En el cas dels malalts per sobre del 50%, cal parar atenció a les comorbiditats.
Classificació actual de la insuficiència cardíaca: quines implicacions hi ha?
En el cas d’insuficiència cardíaca amb fracció d’ejecció reduïda i insuficiència cardíaca amb fracció d’ejecció lleugerament reduïda, no seria necessària una confirmació amb pèptids natriurètics per fer un diagnòstic d’insuficiència cardíaca. Si hi ha símptomes i signes d’insuficiència cardíaca i una fracció d’ejecció per sota del 49%, no necessitem pèptids natriurètics i diagnostiquem la insuficiència cardíaca. Amb malalts amb fracció d’ejecció preservada, a més dels símptomes i signes, necessitem alteracions estructurals o funcionals, com alteracions en l’ecocardiograma o pèptids natriurètics elevats.
Recentment, l’any 2022, a les guies americanes ha aparegut una nova classificació amb una nova família: els malalts amb insuficiència cardíaca i fracció d’ejecció recuperada. Es tracta de pacient que tenia una fracció d’ejecció reduïda (per sota del 40%) i que en el seguiment i gràcies a l’optimització del tractament mèdic, es comprova un augment de més de deu punts percentuals de la fracció d’ejecció i l’ecocardiograma mostra fracció d’ejecció per sobre del 40%.
Pel que fa als fenotips d’insuficiència cardíaca amb fracció d’ejecció reduïda, cal tenir en compte la presència o no de comorbiditats com la fibril·lació auricular, la insuficiència renal, la hiperpotassèmia i el valor de la freqüència cardíaca o de la pressió arterial. En els fenotips d’insuficiència cardíaca amb fracció d’ejecció preservada, cal tenir en compte que la hipertensió arterial i les comorbiditats juguen un paper clau. En aquest cas, s’ha de considerar l’envelliment, la cardiopatia isquèmica, la hipertensió pulmonar i l’obesitat. Al costat d’aquestes patologies principals, s’aglutinen altres comorbiditats, com la fibril·lació auricular, l’anèmia, l’EPOC, l’apnea obstructiva del son, la diabetis i la insuficiència renal. Per aquest motiu, en aquests casos, es fa més complicat l’abordatge d’una insuficiència cardíaca.
Tractament: noves guies de la Societat Europea de Cardiologia
Hi ha hagut una família de fàrmacs que realment ha provocat un gran canvi: els inhibidors del SGLT2. Al principi, aquests fàrmacs es donaven per a la diabetis. Als estudis d’extensió per valorar l’impacte cardiovascular, es va comprovar que els individus que prenien aquests fàrmacs tenien menor risc d’ingrés hospitalari per insuficiència cardíaca. A partir d’aquí, es va plantejar que els inhibidors SGLT2 s’utilitzessin com a tractament de la insuficiència cardíaca. Inicialment, es van fer estudis en insuficiència cardíaca amb fracció d’ejecció reduïda. Posteriorment, s’han fet estudis en insuficiència cardíaca amb fracció d’ejecció preservada. Tant uns com altres permeten concloure que aquests fàrmacs milloren el pronòstic de les persones amb insuficiència cardíaca, independentment del valor de la fracció d’ejecció. Així doncs, redueixen els esdeveniments cardiovasculars majors i el risc d’ingressar per una insuficiència cardíaca.
Les guies europees, que van ser publicades l’any 2021, presenten un canvi important. En concret, amb malalts amb insuficiència cardíaca i fracció d’ejecció per sota del 40%, es posen al mateix nivell els quatre fàrmacs fantàstics: IECA/ARNI, betablocadors, antagonistes de l’aldosterona i inhibidors del SGLT2 (nova incorporació). En les anteriors edicions, es proposava una titulació esglaonada. En canvi, en les guies actuals, s’aposta per una estratègia molt més agressiva, dient que els quatre fàrmacs s’han d’emprar d’entrada, com més aviat millor. També fan èmfasi en el maneig de les comorbiditats i en l’abordatge multidisciplinari en la gestió de la insuficiència cardíaca i donen recomanacions perquè es pugui fer un monitoratge remot.
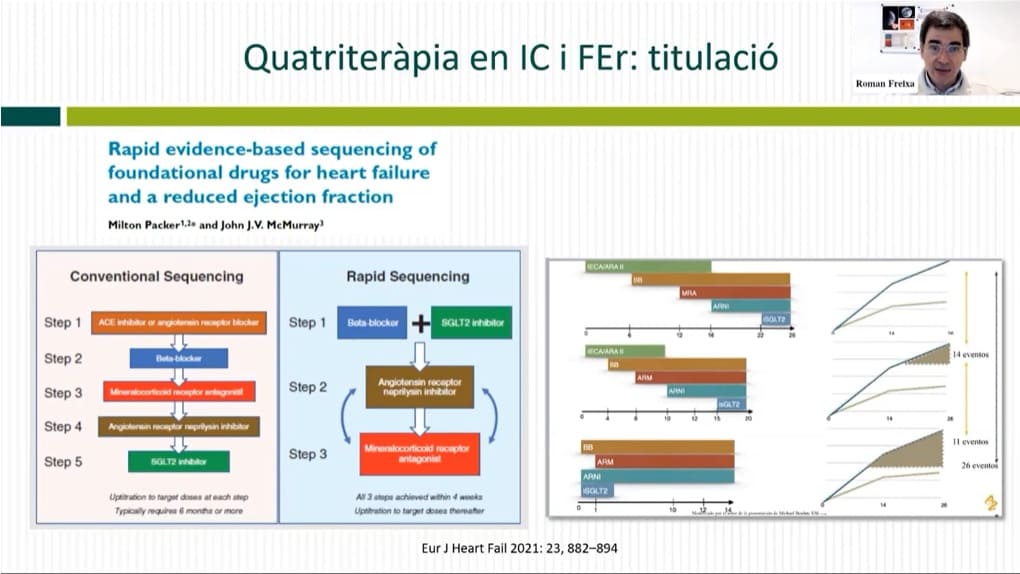
Tractament: vies d’actuació per a insuficiència cardíaca i fracció d’ejecció reduïda
Així doncs, hi ha quatre fàrmacs i diverses vies d’actuació amb els malalts que tenen insuficiència cardíaca i fracció d’ejecció reduïda. Aquests malalts han de rebre els quatre tipus de fàrmacs descrits, tot i que cal tenir en compte altres factors, com una ferropènia, una regurgitació mitral severa, una insuficiència renal o una fibril·lació auricular.
Els quatre fàrmacs s’han de donar en les primeres quatre setmanes als pacients amb fracció d’ejecció per sota del 40% i s’han de mantenir en els pacients amb insuficiència cardíaca i fracció d’ejecció lleugerament reduïda i en els pacients amb insuficiència cardíaca i fracció d’ejecció recuperada. En aquest sentit, els inhibidors de SGLT2 estan presents en l’espectre complet de pacients amb insuficiència cardíaca, tant preservada com deprimida.
També, en funció de si el malalt té unes característiques en l’electrocardiograma o si l’etiologia de la seva insuficiència cardíaca és isquèmica o no, es recomana amb més o menys intensitat la utilització de desfibril·ladors o teràpies de resincronització cardíaca. Així mateix, es fa èmfasi en el dèficit de ferro, que es controla amb l’índex de saturació de la transferrina i la ferritina.
De la mateixa manera, cal entendre que el valor de la fracció d’ejecció pot ser variable, ja que és dinàmic en el temps. Els malalts més joves que reben un bon tractament és més probable que evolucionin d’una fracció d’ejecció reduïda a una fracció d’ejecció preservada. En canvi, els malalts més grans que no reben el tractament adequat és més fàcil que passin d’una fracció d’ejecció preservada a una insuficiència cardíaca sistòlica amb depressió de la funció ventricular.
Tractament: administració de la medicació per a insuficiència cardíaca i fracció d’ejecció reduïda
Les guies europees de l’any 2021 mostren una estratègia diferent a les anteriors de 2016. D’aquesta manera, es passa d’una titulació seqüencial a una titulació simultània amb les quatre famílies de fàrmacs. En el cas dels inhibidors de SGLT2, no cal fer una seqüenciació del fàrmac i es pot començar des del principi amb una dosi de deu mil·ligrams (empagliflozina o dapagliflozina) i no cal modificar-la amb el seguiment. En canvi, cal començar amb unes dosis més baixes de IECA/ARNI, betablocadors i antagonistes de l’aldosterona. Progressivament, cal anar modificant-les i incrementant-les fins a aconseguir donar al malalt la dosi màxima tolerada. Malauradament, aquest fet pot condicionar que es produeixin unes setmanes de tractament.
Així doncs, la proposta és donar una miqueta de cadascun d’aquests fàrmacs des de l’inici i anar progressivament augmentant la dosi i optimitzant el tractament durant les següents setmanes. En aquest sentit, en una seqüència ràpida, s’aconsella iniciar amb betablocadors i els inhibidors de SGLT2, seguir amb IECA/ARNI i continuar amb antagonistes de l’aldosterona. Si s’introdueixen les quatre famílies de cop o com més aviat millor amb dosis més baixes, es redueixen els ingressos hospitalaris per insuficiència cardíaca i els esdeveniments cardiovasculars majors. En aquesta línia, els estudis promouen la utilització dels quatre fàrmacs durant l’estada hospitalària del malalt. Això es fa perquè l’ingrés és una oportunitat per optimitzar el tractament o iniciar-lo amb les millors condicions de seguiment, de supervisió i de revisió.
Evidentment, cal tenir en compte altres factors importants de la història clínica del malalt per tal d’ajustar d’una manera individualitzada el tractament.
Tractament: particularitats de la fracció d’ejecció preservada
La insuficiència cardíaca amb la fracció d’ejecció preservada és complexa, perquè hi ha moltes comorbiditats relacionades, com obesitat, sedentarisme, disfunció renal o diabetis. A l’hora de posar en marxa el tractament, cal tenir en compte aquests factors claus.
També cal fer un bon diagnòstic, analitzant els signes i els símptomes i demostrant que hi ha alteracions estructurals o funcionals, amb un NTproBNP elevat. De la mateixa manera, hi ha algunes situacions que predisposen que l’individu tingui una insuficiència cardíaca. Algunes d’aquestes són una fibril·lació auricular, una hipertensió arterial o una hipertensió pulmonar.
Paral·lelament, en alguns pacients, cal fer una prova d’esforç i un ecocardiograma per veure si, amb l’esforç físic, es modifica la pressió de l’artèria pulmonar. Aquest fet demostra que la persona té més risc de patir una insuficiència cardíaca quan fa un esforç físic.
En aquest sentit, hi ha diversos fenotips de pacients amb insuficiència cardíaca i fracció d’ejecció preservada: de tipus cardiometabòlic (obesitat, diabetis i hipertensió), relacionada amb hipertensió arterial i fibril·lació auricular, relacionada amb hipertensió i insuficiència renal o per hipertensió pulmonar. També hi ha pacients amb patologies específiques com poden ser l’amiloïdosi, la miocardiopatia hipertròfica o una valvulopatia. Per tant, a més de fer un bon diagnòstic i valorar la simptomatologia i els factors de risc, els pèptids natriurètics i l’ecocardiograma, cal descartar l’existència d’algunes patologies més concretes i específiques.
Tractament: insuficiència cardíaca i fracció d’ejecció preservada
Les guies europees de l’any 2021 recomanaven un tractament diürètic per millorar la congestió i buscar les etiologies i les comorbiditats cardiovasculars i no cardiovasculars, però no hi havia cap fàrmac específic per aquests tipus de pacients. No obstant això, l’agost de l’any 2021 va aparèixer un estudi amb empagliflozina i malalts amb insuficiència cardíaca i fracció d’ejecció preservada, on es va veure una reducció important de la mort cardiovascular i dels ingressos hospitalaris per insuficiència cardíaca. L’agost de l’any 2022 va aparèixer un nou estudi amb dapagliflozina que confirmava una disminució dels ingressos hospitalaris i de les morts cardiovasculars. En conseqüència, els inhibidors de SGLT2 han demostrat el seu benefici en l’espectre global de la fracció d’ejecció. Així doncs, la notícia és que aquests fàrmacs són els únics que han demostrat ser d’utilitat amb insuficiència cardíaca i fracció d’ejecció preservada.
En resum, en el cas dels pacients amb insuficiència cardíaca i fracció d’ejecció preservada, cal definir i tractar les comorbiditats, posant èmfasi en la fibril·lació auricular i en l’obesitat, no prescriure betablocadors a malalts amb incompetència cronotropa, descongestionar al pacient, descartar i tractar les patologies específiques, com la hipertensió pulmonar, i fer exercici físic.
Tractament: malalts amb insuficiència renal crònica
Excepcionalment, quan un malalt amb insuficiència renal crònica, comença a patir insuficiència cardíaca, s’accelera el deteriorament de la funció renal. Per aquest motiu, interessa introduir estratègies terapèutiques per frenar la situació. Alguns fàrmacs, com els inhibidors de SGLT2, poden ajudar a estabilitzar la situació. En aquest sentit, els betablocadors es poden administrar de forma segura a persones malaltes amb filtrats per sobre de 30 mil·lilitres/minut. En aquesta línia, els IECA/ARNI i els antagonistes de l’aldosterona s’haurien de suspendre si les persones pacients es troben per sota dels 20 o dels 30 mil·lilitres/minut. També, els inhibidors de SGLT2 es poden utilitzar en persones malaltes amb filtrats per sobre de 20 o de 25 mil·lilitres/minut.
Insuficiència cardíaca: una feina de tots i totes
En definitiva, estem davant d’una patologia que requerirà la implicació de tots i totes: infermeria, metges de família, cardiologia, medicina interna, geriatria, nefrologia, endocrinologia, psicologia, farmacologia i molts altres. Estem convidats a aportar la nostra visió al pacient, ja que aquesta patologia acompanyarà la persona malalta durant tota la seva vida. Paral·lelament, a mesura que aquest pacient es torni cada cop més fràgil, hem d’aprendre a anar reduint la intensitat del tractament i anar donant pas al fet que altres professionals més experts que donin suport a la persona malalta i a la seva família en aquesta etapa final de la seva vida.
Així doncs, en etapes avançades, hem de traslladar el focus de fer proves invasives o tractaments agressius per donar suport, confort, pau i acompanyament en aquesta etapa final de la seva vida, així com crear les condicions perquè aquestes persones malaltes puguin morir dignament a casa seva en companyia de les seves famílies i no a les instal·lacions hospitalàries. Per fer-ho, cal treballar de forma coordinada entre els diferents professionals del territori, estant atents a com està evolucionant la trajectòria del pacient per poder actuar amb temps i de manera planificada per oferir-li la millor atenció possible en cada moment i segons les seves necessitats.
Román Freixa Pamias
Cap del Servei de Cardiologia del Complex Hospitalari Moisès Broggi
Podeu veure la gravació de la ponència del doctor Román Freixa al nostre canal de Youtube





 93 380 09 70
93 380 09 70

