Alberto Lleó, neuròleg i director del servei de Neurologia en l’Hospital de la Santa Creu i Sant Pau exposa les novetats en el tractament de la malaltia d’Alzheimer durant la 3a sessió del Curs de Formació Continuada en Gerontologia Clínica i Cures Pal·liatives 2023 que organitza la Fundació Mutuam Conviure.
Actualment ens trobem en un punt d’inflexió en la malaltia de l’Alzheimer gràcies a l’aparició de nous tractaments biològics. Per una banda, aquestes notícies han generat un gran interès en el pacients i les famílies, que pregunten sovint quan hi podran accedir. De l’altra, també han generat certa controvèrsia, quelcom habitual quan hi ha un canvi important en el tractament d’una malaltia. Això és degut a que comportaran un canvi de paradigma en el tractament de la malaltia amb uns protocols radicalment diferents dels que fem actualment. Així, em centraré sobretot en aquestes noves notícies i en els tractaments que vindran i no tant en repassar el tractament farmacològic actualment aprovat, que pràcticament no ha canviat en els últims 20 anys.
Abans de començar vull també deixar palesos els meus conflictes d’interessos. He estat consultor de moltes de les companyies que estan desenvolupant aquests fàrmacs biològics per la malaltia de l’Alzheimer. També he sigut investigador principal de l’estudi “Clarity”, amb el qual la companyia Eisai vol demanar l’aprovació a Europa del fàrmac biològic Lecanemab. Lecanemab ja està aprovat als Estats Units i a Europa començarem a veure les respostes de les agencies reguladores en els propers mesos o anys.
La biologia de la malaltia d’Alzheimer
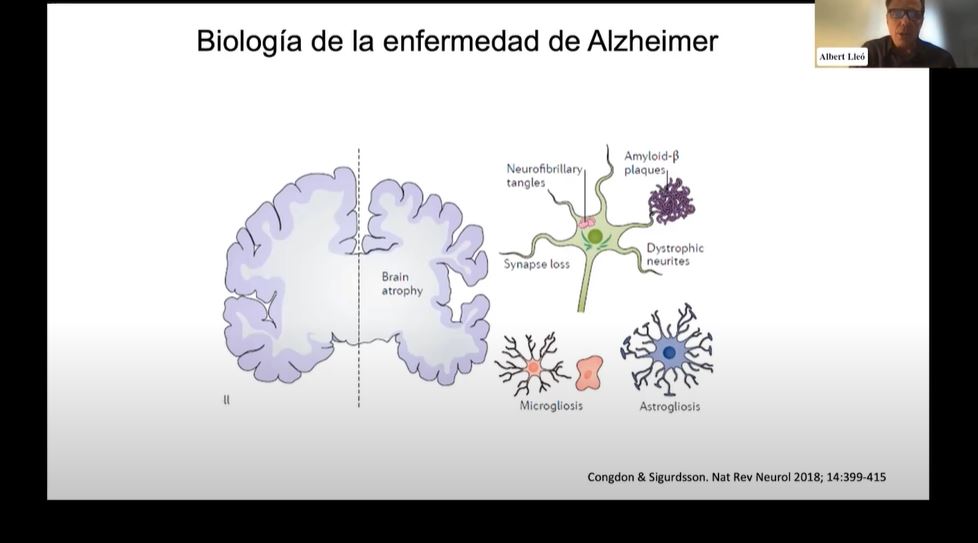
Sobre la biologia de la malaltia d’Alzheimer, no m’estendré gaire, però cada vegada se sap més quins són els canvis que provoca en el cervell. És una malaltia molt llarga, del voltant de tres dècades, i té un període d’incubació també molt extens. Durant aquest període d’incubació, la persona no nota res, però a nivell cerebral ocorren una sèrie de canvis i de lesions que finalment es manifesten. El fet que tingui un període d’incubació tan llarg, fruit de l’habilitat del cervell per compensar, és una limitació important per al desenvolupament de tractaments.
Les plaques amiloides i els cabdells neurofibril·lars són les dues lesions neuropatològiques que hi ha al cervell en la malaltia d’Alzheimer. Les plaques amiloides estan formades pel dipòsit de la proteïna beta-amiloide, que és la que ha centrat els esforços terapèutics en els últims anys. Al seu torn, els cabdells neurofibril·lars estan formats per l’acumulació al cervell de la proteïna tau. També hi ha diverses teràpies que estan dedicades a eliminar o a atacar aquesta proteïna. A part, hi ha altres canvis, bàsicament inflamatoris, en la resta de les cèl·lules cerebrals com la micròglia i l’astroglia i també, cada vegada, hi ha més interès en desenvolupar eines terapèutiques per a aquestes altres respostes.
L’anàlisi dels biomarcadors en la malaltia d’Alzheimer
En les últimes dues dècades, el coneixement de què passa a nivell biològic en la malaltia d’Alzheimer no ha canviat de manera gaire substancial. Però sí que ho ha fet la nostra capacitat de mesurar els seus processos in vivo, en els pacients i en les persones voluntàries que s’ofereixen a la investigació, mitjançant diversos biomarcadors. Aquests marcadors són, fonamentalment, proteïnes que podem mesurar en líquid, en sang, o a través de tècniques de PET. El seu anàlisi ens servirà per examinar què passa en els processos al llarg de la malaltia. En aquest sentit, actualment tenim bons marcadors de plaques amiloides i de cabdells neurofibril·lars. D’altra banda, estem treballant en els marcadors de sinapsis, dels quals tenim una línia de recerca bastant activa ara mateix. Finalment, també podem mesurar les cèl·lules inflamatòries com la micròglia o l’astroglia.
Els biomarcadors de LCR en la malaltia d’Alzheimer
Com sabeu, el diagnòstic de la malaltia d’Alzheimer avui dia és biològic, a partir de l’estudi del líquid cefaloraquidi, on s’hi pot observar un perfil de proteïnes característic de la malaltia.
Introduir aquesta prova no va ser fàcil. Al 2009, fa 15 anys, vam començar a fer les primeres puncions lumbars i en aquell moment va ser quelcom molt controvertit. Posteriorment, s’ha acceptat que tenen una gran utilitat clínica, ja que demostren, per exemple, que pacients a qui s’havia diagnosticat Alzheimer, no en tenen. Tot i així, a l’Hospital de Sant Pau vam necessitar 10 anys per aconseguir validar la tècnica i introduir-la al petitori com qualsevol altra prova. Avui en dia ja és una rutina clínica en molts centres del món.
Tanmateix, aquest estudi no es fa a tothom per varis motius. Primer, perquè a vegades hi ha pacients que ho tenen contraindicat. Segon, perquè hi ha proves que no són accessibles a tots els centres encara que la seva utilitat estigui demostrada des de fa anys. Amb tot, el seu el ús està creixent i nosaltres el fem a gairebé tots els pacients en fases inicials. En relació a això, cal dir que l’estudi perd utilitat a mesura que la malaltia avança o la persona envelleix. Per això, es reserva a persones que no siguin molt grans, que no tinguin gaires comorbiditats i que estiguin en les fases inicials de l’Alzheimer. Com dèiem, el seu ús va creixent any rere any i cada vegada ens recolzem més en aquest tipus de proves biològiques, que seran totalment essencials quan tinguem un tractament biològic per l’Alzheimer.
Els biomarcadors en sang en la malaltia d’Alzheimer
En aquests últims 5 anys s’ha produït un gran boom en la investigació a causa dels avenços en l’estudi dels marcadors en sang. Fruit també de la tecnologia, han sortit una sèrie de marcadors que permeten mesurar els canvis de la malaltia d’Alzheimer a nivell cerebral amb una mostra de sang. Això vol dir que podem mesurar, per exemple, els nivells de proteïna beta-amiloide en sang, que correlaciona amb les plaques amiloides, i de proteïna tau fosforilada, que correlaciona amb la càrrega de cabdells neurofibril·lars al cervell. També podem mesurar la neurodegeneració a través dels neurofilaments, un marcador que s’ha fet molt popular perquè també té molta utilitat en altres malalties, com l’esclerosi múltiple. Addicionalment, podem marcar l’activació inflamatòria com els astròcits a través de la proteïna àcida fibril·lar glial.
Cal dir que, a diferència dels del líquid cefalorraquidi, els marcadors en sang encara no estan aprovats per a l’ús clínic, només com a marcadors de recerca. Tot i això, a causa de la seva utilitat, sobretot la del marcador de la proteïna tau i dels neurofilaments, la seva aprovació és qüestió de temps.
En el cas de la proteïna tau, se sap que correlaciona molt bé amb el diagnòstic de la malaltia d’Alzheimer i que, per tant, pot ser una eina de cribratge molt útil i mot més accessible que l’estudi del líquid cefalorraquidi. Pel que fa als neurofilaments, cal dir que es tracta d’una proteïna inespecífica, és a dir que es troba alterada, bàsicament, en qualsevol malaltia que cursa amb dany neurològic. Així doncs, en les malalties degeneratives, com l’ELA, l’Alzheimer, la demència frontotemporal i altres demències, es troba molt elevada. També, en l’esclerosi múltiple. Així en l’Alzheimer, els neurofilaments són un marcador menys específic que d’altres.
La proteïna tau fosforilada en plasma
El que sí tindrà un impacte aviat en el diagnòstic és la mesura de proteïna tau fosforilada en sang. L’any 2020, diversos estudis van demostrar que els pacients amb Alzheimer tenien els marcadors de tau fosforilada en sang elevats. A més, van provar que es tractava de quelcom específic d’aquesta malaltia. Això significa que, si mirem altres malalties neurodegeneratives, els nivells seran normals. Així doncs, tenim un marcador específic d’Alzheimer que es pot detectar en sang sense la necessitat d’una punció lumbar i que ens pot servir com una primera evidència d’un procés de fisiopatologia d’Alzheimer a nivell cerebral.
Aquest marcador avui dia encara està en fase de recerca, però les companyies ja estem parlant de quan estarà disponible per a l’ús clínic. A Sant Pau fa anys que hi treballem i veiem que són útils igual que ho vam veure al principi amb el líquid cefalorraquidi. Ara ja estem treballant en trobar quins són els punts de tall per decidir si el pacient passa a fer-se una punció lumbar o no.
L’aproximació terapèutica
Amb tot, el més important és l’aproximació terapèutica i em vull centrar en això, ja que ens trobem en un punt d’inflexió. M’agrada comparar aquest moment amb un nou dia, perquè tenim resultats positius en assajos clínics per primera vegada després de 2 anys de resultats negatius. Així doncs, tenim en un horitzó molt proper els primers tractaments biològics que canviaran radicalment la manera de tractar les demències en general i la malaltia d’Alzheimer en particular.
Des del 2006 fins ara no ha canviat res en relació al tractament de l’Alzheimer. Seguim tenint el mateixos fàrmacs, els IACES i la memantina, tot i que amb formulacions noves. Per a explicar millor l’evolució del tractament i el moment actual, m’agrada recordar la història de la hipòtesi colinèrgica, sobre la qual es basen els IACES, els inhibidors de l’acetilcolinesterasa. Aquesta hipòtesi va ser postulada l’any 1976 en un article publicat a The Lancet que demostrava que hi havia un dèficit d’acetilcolina en la malaltia d’Alzheimer. La troballa va impulsar una onada de recerca de nous tractaments i no va ser fins l’any 1995, vint anys més tard, que es va aprovar el primer fàrmac colinèrgic per a l’Alzheimer: la Tacrina, el primer IACE.
Així doncs, aquesta hipòtesis va guiar el desenvolupament farmacològic fins que 20 anys després es va torbar el primer fàrmac. Ara ens trobem en una situació bastant similar amb la hipòtesis amiloide.
La hipòtesis amiloide en la malaltia d’Alzheimer
La hipòtesis amiloide postula que les plaques amiloides juguen un paper important com a desencadenant d’una cascada de fenòmens que acaben produint la pèrdua neuronal i la pèrdua sinàptica, que és el que ocasiona els símptomes de l’Alzheimer. Aquesta hipòtesi es va establir als anys 80, quan es va detectar el primer pèptid beta-amiloide, identificat el 1984. Als anys 90, es van veure les primeres alteracions genètiques en el gen que codificava la proteïna precursora amiloide en l’Alzheimer i això va generar, l’any 92, la hipòtesis de la cascada amiloide. L’any 2023, la FDA ha aprovat el primer tractament antiamiloide en Alzheimer. És a dir, que hem necessitat 30 o 40 anys per replicar el que va passar amb la hipòtesis colinèrgica.
La recerca d’un tractament per a la malaltia d’Alzheimer
Parlaré nomes dels tractaments antiamiloides i, concretament, em centraré en el Lecanemab perquè és el primer que tenim a l’horitzó. Amb tot, cal dir que hi ha hagut una explosió en la recerca de nous tractaments per a la malaltia d’Alzheimer. A dia d’avui hi ha 143 fàrmacs en 172 assajos, la majoria dels quals, el 83% són modificadors. És a dir, ja no busquem tractaments simptomàtics com els que tenim actualment aprovats, sinó que la recerca vol tractaments que modifiquin els processos biològics fonamentals de la malaltia. Una altra dada importat és que el 70% dels estudis no van dirigits a la proteïna amiloide ni a la tau, sinó que busquen altres dianes. La gran majoria de recerca es focalitza en les fases inicials de la malaltia i en poder fer diagnòstics més primerencs.
El Lecanemab, versió humanitzada de Mab158
La història del Lecanemab, que és el fàrmac que la FDA ha aprovat aquest any, per a mi és molt bonica i inspiradora. Tot comença quan el psiquiatra geriatra suec Lars Lannfelt observa que a Suècia hi ha famílies que presenten la malaltia d’Alzheimer a edats molt precoces. El doctor Lannfelt va descobrir, en el gen de la proteïna precursora de l’amiloide, la mutació que ho causava. A partir d’aquí, també estudià el cervell d’aquestes persones, que morien molt joves. En aquests estudis va veure que les plaques d’amiloide eren diferents a les que trobem en els pacients amb Alzheimer: tenien unes protofibrilles. Lannfelt va postular que aquestes protofibrilles eren més tòxiques i va decidir generar anticossos contra elles.
Així és com va néixer el fàrmac Lecanemab, la versió per a humans de l’anticòs que va crear Lannfelt en els seus estudis amb ratolins. Va ser ell qui publicar els primers estudis que demostraven que aquest anticòs era específic i que, com que era derivat contra una forma tòxica, podia tenir potencial terapèutic.
Aquest descobriment el va portar a crear una companyia, que més endavant va ser llicenciada a una de més gran i després a una altra. Això és quelcom que passa en la majoria d’assajos clínics, ja que sempre arriba un moment en què el finançament és impossible d’assumir. Primer es va llicenciar a Eisai i després a Biogen.
Els estudis amb Lecanemab en la malaltia d’Alzheimer
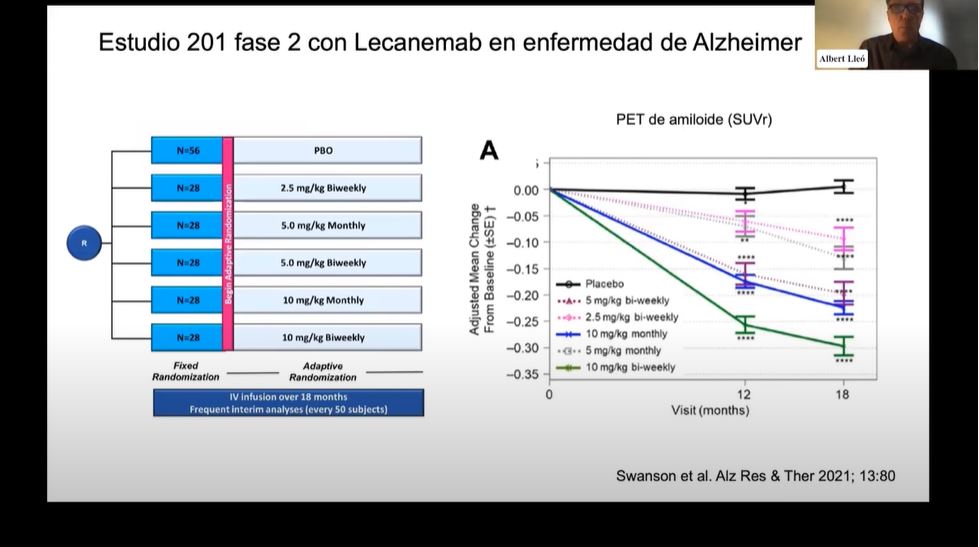
La fase 2 de l’estudi va mostrar dades molt esperançadores. En primer lloc, va evidenciar que la potencia antiamiloide d’aquest fàrmac era molt alta. Podia disminuir significativament la càrrega amiloide en un any si es donava cada dues setmanes i les persones acabaven pràcticament sense amiloide a nivell cerebral. Així, es va decidir que l’administració més òptima era cada dues setmanes, cosa que tindrà unes implicacions enormes en la pràctica clínica. A més, en aquesta fase van veure que els pacients que havien rebut la dosi cada dues setmanes tenien una milloria cognitiva i funcional respecte els que rebien placebo.
Aquestes troballes van motivar passar a la fase 3, és a dir, a l’estudi “Clarity”, que es va publicar al New England Journal of Medicine a finals de l’any passat coincidint amb la presentació a San Francisco dels resultats. La companyia es basa en aquet estudi per demanar l’aprovació a les agencies reguladores.
Els estudis amb Lecanemab en la malaltia d’Alzheimer: l’estudi “Clarity”
“Clarity” és un estudi molt gran, amb gairebé 900 persones amb Alzheimer que van rebre el medicament i 900 més que van rebre placebo. El primer que va demostrar és que hi ha una potencia antiamiloide molt importat. Es pot veure una diferència molt clara entre el placebo i el fàrmac en la disminució de la càrrega amiloide, que va baixant progressivament. Així, al cap de tres mesos ja es comença a notar la diferència i, als 18, que és quan acaba l’estudi, aquesta és molt marcada.
La variable principal va ser el CDR Suma de Caixes (CDR-SB), molt utilitzada en assajos clínics. Es tracta d’una escala mixta, és a dir, cognitiva i funcional; així que tradueix els dos components que són importants per als assajos. Aquesta escala va mostrar una diferència de 0,45 punts, fet que va generar discussió sobre si aquesta xifra era clínicament rellevant o no. Amb tot, si fem els càlculs, veiem que representa un 27% de benefici en la variable principal. D’altra banda, si mirem les variables secundaries cognitives, com les escales funcionals i les de qualitat de vida, veiem que també hi ha resultats significatius.
Els resultats l’estudi “Clarity”
Per primera vegada, doncs, estem davant d’un estudi clarament positiu. Anteriorment un altre fàrmac, l’Aducanumab, havia mostrat resultats tant positius com negatius, per la qual cosa va ser bastant controvertit. Així doncs, hem pogut quantificar un 27% de benefici en 18 mesos, un període bastant curt de temps. Òbviament, cal esperar a veure què passa amb seguiments més llargs, però hi ha la conjectura que aquestes diferencies aniran augmentat a mesura que passi el temps.
Pel que fa al subanàlisi hi van haver algunes troballes interesants, com una petita diferència entre homes i dones que caldrà analitzar. També, un efecte contraintuïtiu en què els pacients més grans tenien més resposta. Això pot tenir relació amb la barrera hematoencefàlica, que es fa més permeable al fàrmac i, per tant, es rep una dosi més alta. Un altre element a destacar és que sembla efectiu en les fases de deteriorament cognitiu lleu i que hi ha una petita diferència en la resposta en funció de si el genotip és ApoE4 o no, però tots dos es beneficien d’aquest tractament.
Els estudis amb Lecanemab en la malaltia d’Alzheimer: marcadors
Els marcadors també recolzen que hi ha una modificació dels processos fonamentals de la malaltia d’Alzheimer. Quan es mira l’estudi de líquid cefalorraquidi, es veu clarament que el fàrmac altera en el sentit esperat els marcadors d’amiloide i de tau. També ho fa en altres marcadors de neurodegeneració, però no hi ha canvis en el marcador dels neurofilaments. Probablement, aquesta excepció es deu al fet que no és un marcador específic de la malaltia d’Alzheimer. D’altra banda, quan mirem els marcadors en sang també trobem els canvis esperats. Així, hi ha un canvi en els marcadors en plasma de beta-amiloide i de proteïna tau i també d’altres marcadors com inflamatoris, astrocitaris i GFAP. En canvi, de nou, no hi ha modificacions a nivell de neurofilaments en plasma
Els estudis amb Lecanemab en la malaltia d’Alzheimer: seguretat
El que més ha preocupat d’aquest estudi és la seguretat perquè sabem que els anticossos antiamiloides tenen com efectes adversos principals l’edema cerebral i les microhemorràgies. Aquests efectes es solen donar en les primeres administracions. En el cas del nostre estudi, l’edema es va donar en un 12% dels pacients i les microhemorràgies, en un 17%.
La majoria de vegades els efectes adversos són asimptomàtics, però hi ha un percentatge que sí que pot donar símptomes. Això no és res nou, sinó que es tracta d’un tipus de reacció inflamatòria a l’amiloide cerebral que s’ha donat també fora d’aquests assajos d’Alzheimer. Aquesta reacció consisteix en un quadre dins de la angiopatia amiloide inflamatòria i que es tracta amb corticoides de manera endovenosa. És a dir, els fàrmacs, d’alguna manera, provoquen una reacció molt similar a aquesta que ja coneixíem i que és extremadament rara.
Tanmateix, això ha estat subjecte a una controvèrsia important perquè hi ha hagut tres morts a nivell mundial atribuïbles al fàrmac. El que va tenir més ressò va ser un pacient que estava prenent el fàrmac i va tenir un ictus. Se’l va tractar amb trombòlisis, que és el procediment actual, i al cap d’uns minuts de prendre el tractament va tenir una hemorràgia múltiple a nivell cerebral i va morir. Això també posa de manifest tota la complexitat que haurem de tenir en compte i que caldrà veure els riscos que comporten aquest fàrmacs quan s’aprovin.
Un altre cas que va sortir a la premsa va ser el d’un pacient amb múltiples microhemorràgies també relacionades amb el tractament amb Lecanemab. Aquests casos es poden tractar amb corticoides i es resolen, pràcticament sempre, sense complicacions suspenent la dosi i reiniciant el tractament.
El tractament amb Lecanemab en la malaltia d’Alzheimer: últimes notícies
El 6 de gener de 2023 l’FDA va aprovar l’ús de Lecanemab, per la via accelerada, sota el nom comercial es LEQEMBI. S’està pendent de l’aprovació ordinària per la via tradicional, que es preveu que es produeixi en breu. També s’han iniciat els tràmits per sol·licitar l’aprovació a la Xina i s’ha enviat a l’Agència Europea del Medicament la documentació per a l’aprovació a Europa. La resolució de l’EMA s’espera a finals d’aquest any i, un cop rebuda, caldrà l’aprovació de les agències nacionals de cada estat. Així, és possible que algunes agències l’aprovin en dos mesos i d’altres, triguin més.
El tractament amb Lecanemab en la malaltia d’Alzheimer: indicacions
Les indicacions serien les mateixes que a l’estudi, és a dir, en fases lleus, amb deteriorament cognitiu o demència lleus. A més, cal fer al menys quatre ressonàncies per valorar el procés. El preu de sortida del tractament és de 26.500 dòlars l’any i només inclou fàrmac. A aquesta xifra caldrà sumar-hi les ressonàncies, el diagnòstic, l’hospital i altres costos.
Conclusions
Per acabar, voldria repassar els punts més importants que hem vist:
- Estem davant del primer assaig clínic amb un agent biològic clarament positiu en la malaltia d’Alzheimer.
- Els biomarcadors demostren una marcada reducció d’amiloide i d’altres marcadors de processos fisiopatològics que suggereixen que hi ha una modificació de la fisiopatologia.
- És el segon anticòs amiloide aprovat per la FDA. El primer va ser l’Aducanumab, tot i que el seu ús està essent molt restringit per la controvèrsia de les dades.
- A nivell de seguretat, si s’acaba aprovant, cal tenir en compte que provoca un efecte advers conegut que és l’edema i la microhemorràgia.
- És importat determinar quin és el benefici a llarg termini, més enllà dels 18 mesos de l‘estudi.
Així doncs, en resum, estem davant d’una nova era que canviarà el paradigma complert de com tractem els pacient i com abordem aquesta malaltia. Aquest nou paradigma ens obligarà a fer un diagnòstic en un temps ràpid per assegurar que el pacient pot rebre el tractament . A més, serà necessari reformular totalment les infraestructures que actualment tenim dedicades al diagnòstic i al tractament d’aquests pacients.
Alberto Lleó
Director del servei de Neurologia
Hospital de la Santa Creu i Sant Pau
- Podeu veure la gravació de la ponència al nostre canal de Youtube.





 93 380 09 70
93 380 09 70